 杨冰
杨冰
阅读量:544
乳腺癌是全球女性发病率最高的恶性肿瘤,每年新发病例超过200万。尽管早期筛查和综合治疗手段的进步显著提升了患者生存率,但晚期乳腺癌的治疗仍面临巨大挑战,尤其是人表皮生长因子受体2(HER2)低表达患者的治疗困境长期未解。这类患者约占乳腺癌总数的50%-60%,过去因缺乏有效靶向药物,长期被归类为“HER2阴性”群体,治疗方案局限于化疗或内分泌治疗,预后普遍较差。然而,随着抗体偶联药物(Antibody-Drug Conjugate, ADC)的突破性进展,这一局面正被彻底颠覆——以德曲妥珠单抗(Enhertu, DS-8201)为代表的ADC药物,不仅重新定义了HER2表达的临床意义,更开创了乳腺癌精准治疗的新时代。
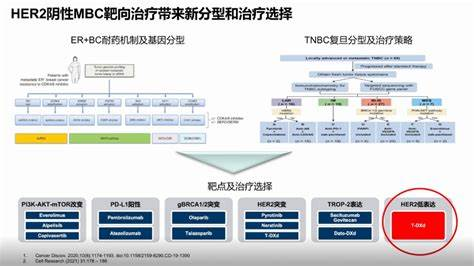
HER2是一种跨膜酪氨酸激酶受体,其过度表达(HER2阳性)可驱动肿瘤细胞增殖和转移。自上世纪90年代赫赛汀(曲妥珠单抗)问世以来,HER2阳性乳腺癌患者的生存率显著提升,但占多数的HER2低表达患者却被排除在靶向治疗之外。传统检测方法(免疫组化IHC和荧光原位杂交FISH)将HER2状态简化为“阳性”(IHC 3+或FISH扩增)或“阴性”(IHC 0或1+),而IHC 2+但FISH阴性的“临界值”患者则需重复检测。这种二分法导致大量HER2低表达患者(IHC 1+或2+/FISH阴性)无法从抗HER2治疗中获益。
生物学视角的革新
近年研究揭示,HER2表达并非“全或无”的二元状态,而是一个连续谱系。即使IHC 1+的肿瘤细胞,其表面仍存在少量HER2蛋白,这些蛋白可能不足以激活下游信号通路,但足以成为ADC药物的靶点。这一发现彻底颠覆了HER2分类范式,推动临床从“定性判断”转向“定量分层”。
临床需求的倒逼
HER2低表达患者对传统化疗响应有限,内分泌治疗仅适用于激素受体阳性(HR+)亚型,而三阴性乳腺癌(TNBC)患者更是面临“无靶可打”的困境。这类患者的5年生存率较HER2阳性患者低15%-20%,亟需新型治疗策略。
ADC由三个核心组件构成:靶向肿瘤抗原的单克隆抗体、细胞毒性载荷(小分子化疗药物)以及连接两者的化学连接子。其设计理念类似于“智能导弹”——抗体作为导航系统识别肿瘤细胞表面抗原,连接子确保药物在血液循环中稳定,而进入肿瘤细胞后,连接子断裂并释放高活性细胞毒素,实现精准杀伤。
技术突破的三重革命
1. 高亲和力抗体:新一代ADC采用人源化或全人源抗体,减少免疫原性并提升靶向效率。例如,德曲妥珠单抗的抗体部分对HER2的亲和力较传统药物提高5倍,可高效结合低表达肿瘤细胞。
2. 可裂解连接子:pH敏感或酶解型连接子(如基于组织蛋白酶的可裂解四肽)确保毒素仅在肿瘤细胞内释放,减少脱靶毒性。
3. 强效载荷升级:传统ADC多使用微管抑制剂(如美登素),而新一代药物采用拓扑异构酶Ⅰ抑制剂(如依沙替康衍生物DXd),其杀伤效力比常规化疗高1000倍,且具有“旁观者效应”——可穿透细胞膜杀伤邻近低抗原表达的肿瘤细胞,这对异质性强的乳腺癌尤为重要。
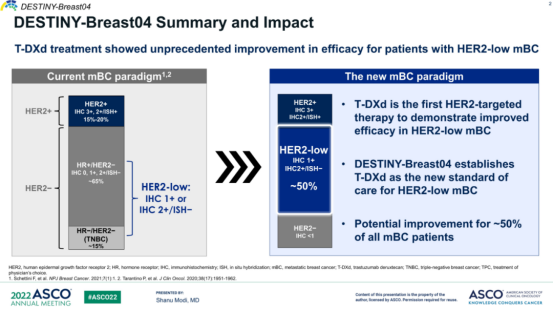
2022年6月,美国临床肿瘤学会(ASCO)年会公布了DESTINY-Breast04试验的里程碑结果:在HER2低表达晚期乳腺癌患者中,德曲妥珠单抗相比化疗显著延长无进展生存期(PFS 9.9个月 vs. 5.1个月)和总生存期(OS 23.4个月 vs. 16.8个月),且无论HR状态如何均显示获益。这一成果首次证明HER2低表达可作为ADC治疗的生物标志物,直接促成美国FDA加速批准德曲妥珠单抗用于HER2低表达乳腺癌,并推动NCCN指南将其列为二线治疗优选。
亚组分析的启示
· HR+患者:德曲妥珠单抗组中位PFS达10.1个月,较化疗组(5.4个月)近乎翻倍,为内分泌耐药患者提供新选择。
· 三阴性乳腺癌(TNBC):尽管TNBC仅占试验人群的15%,但德曲妥珠单抗仍将中位OS从8.3个月提升至18.2个月,提示ADC可能重塑TNBC治疗格局。
· 脑转移患者:既往认为ADC药物难以穿透血脑屏障,但该试验中脑转移亚组OS延长达15.7个月,可能与“旁观者效应”清除微转移灶有关。
德曲妥珠单抗的成功催生了ADC药物的全面布局,治疗场景正快速前移:
1. 晚期一线治疗:DESTINY-Breast09试验探索德曲妥珠单抗联合化疗或免疫治疗用于HER2低表达患者一线治疗,初步数据显示客观缓解率(ORR)超过70%。
2. 新辅助治疗:对于局部晚期HER2低表达乳腺癌,ADC药物可缩小肿瘤以提高手术切除率。一项Ⅱ期试验中,德曲妥珠单抗联合化疗的病理完全缓解(pCR)率达35%,远超历史数据。
3. 辅助治疗:针对完成手术但存在高危因素(如淋巴结转移)的患者,ADC可能替代传统化疗,降低复发风险。
联合治疗的协同效应
· 免疫检查点抑制剂:ADC诱导的肿瘤细胞死亡可释放抗原,增强PD-1/PD-L1抑制剂的疗效。
· HER2双抗:如赞妥珠单抗(Zenocutuzumab)可阻断HER2/HER3异源二聚体,与ADC联用有望克服耐药。
· 靶向代谢通路:抑制PI3K/mTOR通路可增强ADC的内吞效率,临床前模型显示协同抗肿瘤活性。
ADC药物不仅延长生存期,更显著改善患者生活质量:
· 毒性管理优化:德曲妥珠单抗的主要不良反应为恶心(76%)和中性粒细胞减少(65%),但3级以上毒性发生率低于10%,且可通过预处理药物(如地塞米松)有效控制。
· 治疗周期简化:每3周一次的静脉输注,较传统化疗的每周方案大幅减少住院时间。
· 心理负担减轻:HER2低表达患者摆脱“无药可用”的标签,治疗信心显著增强。
真实世界案例印证
一名52岁HR+/HER2低表达(IHC 1+)晚期乳腺癌患者,在经历多线化疗和CDK4/6抑制剂治疗后进展,接受德曲妥珠单抗治疗3个月后,肺转移灶缩小60%,肿瘤标志物CA15-3恢复正常。治疗期间仅出现轻度乏力,生活质量未受明显影响。
尽管ADC药物前景广阔,仍有诸多问题待解:
耐药机制:HER2表位丢失、药物外排泵上调、载荷代谢失活等均可导致耐药。针对性的双载荷ADC(如同时搭载拓扑异构酶抑制剂和免疫调节剂)或可破解这一难题。
生物标志物精细化:当前HER2低表达的判定依赖主观性较强的IHC检测,数字化病理(如AI定量评分)和液体活检(ctDNA甲基化分析)可能提高分层的准确性。
药物可及性:ADC药物生产成本高昂,年治疗费用超过10万美元。推动国产ADC研发(如维迪西妥单抗)和医保谈判是提升可及性的关键。
下一代ADC的技术跃迁
· 双靶点ADC:如同时靶向HER2和TROP2,可覆盖更广泛的患者群体。
· 条件激活型ADC:仅在肿瘤微环境(如低pH、高蛋白酶浓度)中释放毒素,进一步提升安全性。
· 免疫刺激型ADC:载荷设计为TLR激动剂或STING激动剂,在杀伤肿瘤的同时激活固有免疫。
从HER2阳性到HER2低表达,ADC药物正重新定义乳腺癌的分子分型与治疗边界。这一突破不仅让半数曾被视为“无靶向获益”的患者重获生机,更印证了肿瘤治疗从“粗放型化疗”向“精准生物导弹”转型的必然趋势。随着技术迭代与临床探索的深入,未来ADC有望与基因编辑、人工智能个体化用药等技术深度融合,最终实现乳腺癌的慢性病化管理。而对于无数患者而言,这场静默却深刻的技术革命,正让“与癌共舞”从无奈之选变为充满希望的生命篇章。
 寻找优质医疗资源 伴您走上康复之路
寻找优质医疗资源 伴您走上康复之路 